aca unos ejemplos de lo que pudran encontrar :
Características del Carbono PSU Química
Configuración 1s2
Angulo de enlace 109º 28´
electronegatividad 2.5
El enlace que forma el carbono por lo general , lo hace compartido
electrones es decir covalente, puede compartir sus 4 electrones de
valencia.
 |
Ejemplo :
 |
Aca un mini resumen con las cosas básicas para la psu...
Química Orgánica
También se conoce como química del carbono porque este elemento está presente en todas sus moléculas.
Hay una serie de elementos que forman parte principalmente de estos compuestos: Carbono (C), Hidrógeno (H), Oxí
geno (O), Nitrógeno (N).
El carbono (C) tiene 4 electrones en la capa de valencia. Por tanto va a formar siempre 4 enlaces covalentes.
Los enlaces pueden ser: simples, dobles y triples.
El carbono puede unirse con otros carbonos formando de esta manera cadenas de compuestos carbonados.
El hidrógeno solo tiene un electrón formando un enlace covalente simple.
Los compuestos orgánicos se representan mediante una fórmula que puede ser empírica, molecular y estructural.
Empírica: Con/En la empírica se expresa la proporción en la que están los distintos elementos.
Molecular: Indica el número de átomos totales del compuesto.
Estructural: Indica todos los enlaces que existen en la molécula.
Como la fórmula estructural es muy larga se suele escribir de una manera más simplificada.CH3-CH=CH-CH3Isomería: Dos compuestos orgánicos son isómeros si tienen la misma forma molecular y distinta fórmula estructural. Esto implica que sus propiedades van a ser diferentes.Hidrocarburos: Son compuestos orgánicos formados solamente por carbono e hidrógeno.
Podemos clasificarlos en: Alcanos, Alquenos y Alquinos.
Alcanos: En ellos todos los enlaces Carbono-Carbono (C-C) son simples.
Alquenos: En ellos hay al menos un enlace doble.
Alquinos: En ellos hay al menos un enlace triple.AlcanosNomenclatura de los Alcanos:
- Se cuenta el número de Carbonos de la cadena y se le asigna una raíz en función del número de estos.
1 Carbono: met-
2 Carbono: et-
3 Carbono: prop-
4 Carbono: but-
5 Carbono: pent-
...
- Se le añade el sufijo -ano
- Si existen cadenas ramificadas, utilizamos los siguientes criterios:
a) tomamos como cadena principal a la que mayor número de carbonos tenga
b) asignamos a cada átomo de "C" de la cadena un número localizador.
b) comenzamos a contar por el extremo que tenga más próxima la rama.
d) se nombran anteponiendo el localizador al nombre del hidrocarburo.
e) los nombres de los sustituyentes añadiendo al nombre de la raíz el sufijo -il o -ilo.
- Si aparecen más de un radical (o más de un sustiyente), hemos de nombrar a todos por orden alfabético. Si se repite alguno se le añade el prefijo di-.
Propiedades físicas y químicas de los alcanos
Propiedades físicas
Puntos de ebullición suelen ser bajos y crecen al aumentar la longitud de la cadena. Esto explica que el propano sea gas y el hexano líquido. Los alcanos son insolubles y son gases a temperatura ambiente de bajo peso molecular.
Propiedades Químicas
Los alcanos reaccionan muy poco. La combustión puede ser completa o incompleta.
La combustión es completa cuando el oxígeno es abundante.
La combustión es incompleta cuando el oxígeno es escaso.
Peligros de la combustión Incompleta
- El CO es tóxico.
- Reacciona con la emoglobina de la sangre impidiendo que esta sea transportada con oxígeno a la sangre.
- Puede dar lugar a partículas de carbon no quemadas (este hollín que se deposita en las chimeneas y a la larga puede provocar incendios).
Peligros de la combustión completa
- La combustión completa produce dióxido de carbono (CO2). Este gas ocasiona junto a otros como el metano el efecto invernadero. Este efecto, mantiene la temperatura de la tierra pues impide que salgan las radiaciones infrarojas del suelo.
Actualmente debido al aumento de las combustiones estña aumentando la concentración de CO2 en la atmósfera.
Fuentes de hidrocarburos
- El petróleo: Se obtiene los distintos hidrocarburospor destilación. Al llegar a una refinería se somete al petróleo a una destilación fraccionada, separándolo en distintas fracciones en función de su punto de ebullición. Puede suceder que las cantidades obtenidas de alguna fracción sean insuficientes por lo tanto procede a realizar nuevos procesos, entre ellos está el craqueo (cracking). El craqueo consiste en romper cadenas largas, obteniendo otras mñas pequeñas que sean más útiles. Suele realizarse por medio de calor o en presencia de catalizadores.
- Gas Natural: Es también un combustible fósil que esta formadoprincipalmentepor metano (CH4). Se emplea fundamentalmente para la producción de energía porque es un gas que contamina menos que el carbón pero que también contribuye al aumento de la concentración de CO2. Este metano también puede obtenerse de la descomposición de la materia viva.
Alquenos
Los alquenos son hidrocarburos que tienen un doble enlace carbono=carbono (C=C) en su estructura.
Nomenclatura de los Alquenos:
Propiedades físicas y químicas de los alquenos
- La cadena principal es la que tiene mayor número de dobles enlaces.
- Se empiezan a contar los localizadores de forma que el número que asignemos al enlace sea el menor.
- Se nombran igual que los alcanos sustituyendo el sufijo -ano por -eno indicando el localizador del doble enlace.
Propiedades físicas
Son similares a las de los alcanos
Propiedades químicas
Debido a la presencia del doble enlace estos compuestos son mucho más reactivos que los alcanos. Entre las reacciones más características, se encuentran:
- La adición al doble enlace. Se le añade una molécula rompiendo el doble enlace.
- Polimerización. Los alquenos pueden polimerizarse fácilmente, para ello al calentarlos y en presencia de catalizadores se rompe el doble enlaceformando unas especies químicas inestables. Estas especies químicas se unen entre sí, formando largas cadenas que son los polimeros.
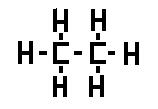




1 comentario:
ta wena
Publicar un comentario